28 abril 2021
28 abril 2021
Vacina pode ser a 1ª contra Covid-19 produzida no Brasil sem importação de matéria-prima, mas só foi testada em animais. Nesta terça, Anvisa solicitou mais informações ao Butantan para liberar testes em humanos.
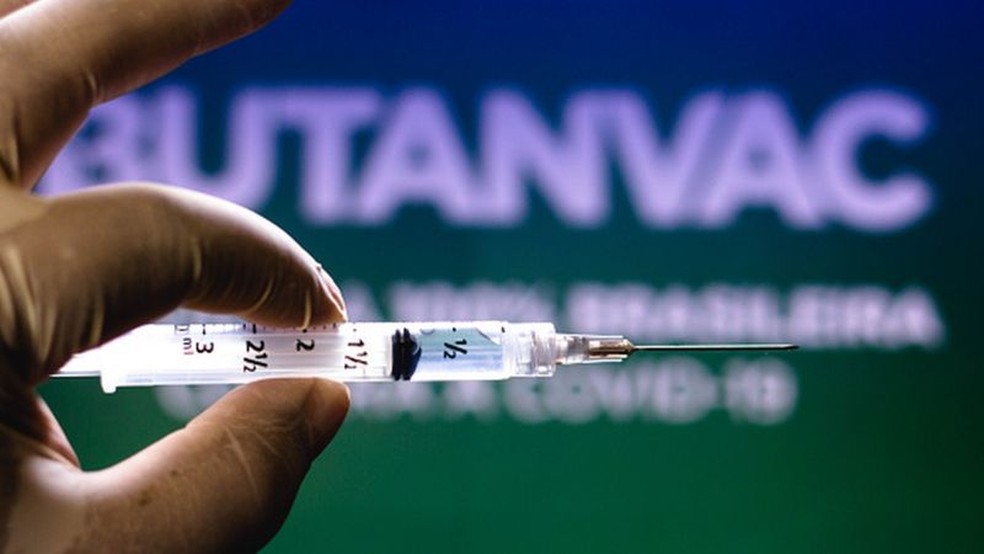
O Instituto Butantan anunciou que vai iniciar nesta quarta-feira (28) a produção da Butanvac, nova candidata a vacina contra a Covid-19 desenvolvida pelo instituto. De acordo com o governo de São Paulo, o primeiro lote de produção será de 1 milhão de doses e não vai depender de matéria-prima importada.
“A novidade de hoje é uma notícia significativa para a ciência brasileira e, por que não, mundial: São Paulo começa hoje a produzir a vacina Butanvac”, disse o governador João Doria (PSDB) em coletiva de imprensa.
Na sexta-feira (26), o Butantan protocolou na Agência Nacional de Vigilância Sanitária (Anvisa) o pedido para iniciar os teste clínicos em humanos de fase 1 e 2 do imunizante. Nesta terça (27), a agência solicitou informações adicionais para avaliar se libera a realização do primeiro estudo com a Butanvac. Até o momento, a vacina foi testada apenas em animais.
O Instituto Butantan tem o prazo de até 120 dias para apresentar as informações solicitadas pela agência. Até o Butantan responder, o prazo de análise da Anvisa fica interrompido. Em nota, o Instituto Butantan afirmou que “manterá contato com o órgão regulador para viabilizar os esclarecimentos necessários ao seguimento do processo de autorização dos estudos clínicos de fases 1 e 2 da Butanvac”.
O diretor do Butantan, Dimas Covas, afirmou que já estão preparando as respostas e disse que as perguntas se referem mais à produção do que ao estudo clínico e já poderiam ter sido feitas em março.
“O que nós queremos da Anvisa é urgência nas suas exigências. O processo original foi submetido dia 26 de março. Muitas das questões que vieram são relativas ao processo de fabricação, e não ao estudo clínico. Portanto já poderiam ter sido solicitadas. É isso que nós queremos da Anvisa: agilidade. Que a Anvisa faça as perguntas que ela tem que fazer no menor prazo possível. É pra isso que eles estão lá, para isso eles são pagos. Num momento de pandemia queremos celeridade porque estamos prontos a responder qualquer questionamento da forma mais rápida possível”, disse.
Dimas Covas pediu que a Anvisa “ajude o povo brasileiro”.
“A Anvisa tem elementos nas suas mãos para fazer essa análise o mais rapidamente possível e autorizar o início dos estudos clínicos, que é o que queremos. […] Anvisa, nos ajude. Ajude o povo brasileiro a ter mais uma vacina no mais curto tempo possível”, disse.
Ao anunciar a produção da Butanvac, Doria declarou que o instituto pretende produzir 18 millhões de doses da vacina até a primeira quinzena de junho, mas que a aplicação do imunizante depende da aprovação da Anvisa.
“O Butantan, nesta primeira etapa, vai produzir 18 milhões da dose da vacina pronta para o uso já na primeira quinzena de junho, quando o processo de aprovação da Anvisa for concluído. Evidentemente vamos aguardar a aprovação da Anvisa, mas poderemos aplicar imediatamente a vacina Butanac em todo o Brasil”, disse Doria.
Autorização para testes
O pedido de autorização do Butantan foi feito em 26 de março, e o protocolo de estudo clínico, em 23 de abril. De acordo com a agência, tanto o pedido quanto o protocolo do estudo clínico estavam incompletos e, por isso, não atendiam aos requisitos técnicos para a liberação de testes da vacina em seres humanos.
O pedido de autorização se refere às fases 1 e 2 de testes da vacina, nas quais serão avaliadas segurança e capacidade de promover resposta imune com 1.800 voluntários. Na fase 3, até 9 mil pessoas irão participar, e a etapa vai estipular a eficácia. O objetivo é encerrar os testes e ter 40 milhões de doses da vacina prontas antes do final de 2021.
Caso seja aprovado e, depois, seja comprovada sua eficácia, a Butanvac será a primeira vacina contra a Covid-19 produzida no país sem que seja necessária a importação de matéria-prima (IFA).
Segundo o instituto, a Butanvac faz parte de uma segunda geração de vacinas contra a Covid-19, e leva em conta as variantes, como da P1, que é brasileira. A tecnologia usada é a mesma da vacina contra a gripe.
Documentação em falta
De acordo com a Anvisa, tanto o pedido de autorização do Butantan quanto o protocolo do estudo clínico ainda estão incompletos e não atendem aos requisitos técnicos para autorizar pesquisas clínicas de vacinas em seres humanos.
Entre os documentos que faltam estão:
Relatório técnico contendo dados e informações sobre a substância ativa, adjuvantes, interação ativo + adjuvante e produto terminado;
Relatório completo com as informações detalhadas sobre fabricantes, etapas de produção, definição de lotes, controle de qualidade, estabilidade, lotes utilizados até o momento e lotes a serem utilizados no estudo clínico;
Dados e informações sobre o processo produtivo da vacina;
Dados e Informações sobre o controle de qualidade da vacina;
Avaliação de risco de geração de doença autoimune e necessidade de avaliar a geração de anticorpos anti DNA por conta de um dos adjuvantes utilizados na vacina;
Esclarecimento se os estudos com animais foram realizados com a mesma formulação que está sendo proposta para teste em seres humanos. Em caso negativo, apresentação de dados de comparabilidade físico-química entre as formulações da vacina;
Esclarecimento sobre o Protocolo Clínico e critérios para escolha de doses e inclusão dos voluntários;
Apresentação de objetivos primários de imunogenicidade e de segurança;
Cálculo do tamanho da amostra e métodos estatísticos utilizados;
Essa não é a primeira vez que a Anvisa pede mais informações ao Butantan antes de autorizar o início dos testes clínicos.
Em 26 de março deste ano, o Butantan divulgou o desenvolvimento do imunizante e enviou à Anvisa o primeiro pedido de autorização referentes às fases 1 e 2 de testes da vacina, quando são avaliadas segurança e capacidade de promover resposta imune.
Na época, o Instituto disse que esperava iniciar os estudos com 1,8 mil voluntários ainda em abril, a depender da liberação da agência.
Fonte: G1