07 janeiro 2021
07 janeiro 2021
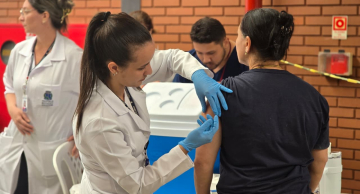
O Instituto Butantan desistiu de pedir o uso emergencial da Coronavac nesta quinta-feira (7), por ainda faltar dados mais claros da eficácia da vacina do laboratório chinês Sinovac, informaram fontes técnicas da Anvisa (Agência Nacional de Vigilância Sanitária) que participam das reuniões com os laboratórios brasileiros nesta semana. O instituto, porém, nega a desistência e diz que o pedido será feito até esta sexta (8).
Um dos técnicos explicou que a eficácia é calculada de forma global, e não dividida entre casos graves e leves, como apresentado em coletiva de imprensa do governo do estado de São Paulo nesta quinta-feira.
Em todas as agências fora do Brasil e com todas as outras vacinas, a eficácia compreendida é a média de todos os estudos. Um outro técnico disse, inclusive, que “esse 100% é totalmente irreal e os 78% é apenas um subgrupo”. O entendimento é de que o governo de São Paulo valorizou o anúncio.
Visto que o Butantan não apresentou a eficácia global, esperada pela agência reguladora, e ainda espera mais dados do laboratório chinês, a entrada com o pedido de uso emergencial não traria uma resposta positiva.
Quando houver a formalização, a Anvisa tem até 10 dias corridos para se manifestar assim que a submissão for feita.
O comunicado da agência confirma as informações passadas pelas fontes. “Por estratégia própria do Butantan, o Instituto não oficializou a submissão de uso emergencial. A reunião de pré-submissão é feita, a critério da empresa/instituição, antes do pedido formal de registro ou da autorização de uso emergencial”, explica o comunicado.
“A Anvisa continuará a avaliação, após a submissão formal do processo com as informações globais de eficácia e segurança da vacina do IB. A agência continua acompanhando o tema e aguardando a estratégia de submissão do IB”, disse.
Documentação indiana
Esses técnicos também informaram que a Fiocruz conseguiu a documentação que faltava, do Instituto Serum, fábrica indiana que está produzindo as doses da vacina de Oxford, em larga escala, para suprir os pedidos de uso emergencial de diversos países.
Agora, portanto, falta apenas a finalização dos documentos. As expectativas continuam sendo para os pedidos serem feitos até sexta-feira (8), quando a Anvisa tem uma nova reunião, mas, desta vez, com o Ministério da Saúde.
Fonte: CNN Brasil
Compartilhe esta notícia